人工的なエンドサイトーシスを起こす光応答性膜変形リポソーム―ウイルスの高効率封入と血中での安定化―
人工的なエンドサイトーシスを起こす光応答性膜変形リポソーム
―ウイルスの高効率封入と血中での安定化―
1. 発表のホ?イント
- 光刺激でリン脂質膜を伸長させる分子機械(AzoMEx)を開発しました。
- AzoMExをリポソームに組み込み、光を照射することで、細胞活動の一つであるエンドサイトーシスに類似した小胞分裂を人工的に誘導することに成功しました。
- M13ファージウイルスの共存下でエンドサイトーシス様の小胞分裂を誘導することで、M13ファージウイルスをリポソーム内へ高効率に封入することに成功しました。
- リポソーム内へ封入したM13ファージウイルスは、血中の免疫細胞など外部環境から保護され、血中投与によって感染性を保持してマウス体内複数組織へ送達可能であることを明らかにしました。
2. 発表概要
申博_申博信用网-官网工学部の内田紀之特任助教、村岡貴博教授らの研究ク?ルーフ? は、細胞活動の一つであるエンドサイトーシスを人工的に模倣し、ウイルスの封入剤へと応用することに成功しました。
エンドサイトーシス(注1)は細胞活動で見られる膜変形現象の一つであり、細胞膜が内側に陥入し、分裂して細胞内で小胞(ベシクル)となることで、細胞外部から生体高分子を高効率で取り込むことを可能にします。エンドサイトーシスは細胞活動においては普遍的な現象であるものの、その動的な膜変形挙動を生理的環境下で人工的に設計することはこれまで困難でした。本研究ク?ルーフ?は、リポソーム(注2)のエンドサイトーシス様の分裂を実現するため、光刺激によってリポソームの内側への分裂に必要である、膜の伸長効果を引き起こすことが可能な分子機械(AzoMEx)(注3)を設計しました。リン脂質であるジオレオイルホスファチジルコリン(DOPC)からなる巨大単層ベシクルにAzoMExを組み込み、光を照射したところ、リポソーム内部への分裂が誘導されることが明らかになりました。さらに、マイクロメートルスケールのウイルスであるM13ファージ(注4)を共存させた状態でベシクルの分裂を誘導したところ、ベシクル内部へ高効率でM13ファージが封入されることが確認されました。封入されたM13ファージは血中の免疫細胞などから保護され、血中投与によって感染性を保持した状態で、マウス体内複数組織へ送達可能であることを明らかにしました。
本成果は、ウイルスを始めとする様々な生体高分子を高効率で封入し、生体内組織へ送達することが可能なキャリア材料として、応用へと繋がることが期待されます。
本研究は、科学技術振興機構(JST) 創発的研究支援事業“細胞膜から着想する生体操作分子の開発”(課題番号:JPMJFR2122、研究代表者:村岡貴博)、戦略的創造研究推進事業CREST“長鎖DNA合成と自律型人工細胞創出のための人工細胞リアクタシステム”領域(課題番号: JPMJCR19S4、研究代表者: 野地博行)、日本学術振興会科学研究費助成事業(課題番号: JP19K15378、内田紀之; JP21H05096、 JP19H02828、JP21H00391、JP21K19209、村岡貴博)なと?の支援を受けて行われました。
3. 発表内容
<研究の背景>
エンドサイトーシスは細胞活動で見られる膜変形現象の一つであり、細胞膜が内側に陥入し、分裂することで、細胞外部から生体高分子を高効率で取り込むことを可能にします。例えば免疫細胞が微生物などの外敵を取り込む際や、神経活動において神経伝達分子を神経細胞内に取り込む際にエンドサイトーシスが利用されます。また、ウイルスが細胞に感染する際にもしばしば利用され、申博_申博信用网-官网もエンドサイトーシスの経路によって細胞内へ侵入します。このようにエンドサイトーシスは細胞活動において普遍的な現象であり、生体高分子をリポソーム内部へ取り込むために理想的な機能であるものの、その動的な膜変形挙動を、生理的環境下で人工的に模倣することはこれまで困難でした。特にエンドサイトーシス様の内側へのベシクル分裂は、膜の伸長を伴う熱力学的に不利な膜変形現象であり、その課題を克服する方法論は今まで確立されていませんでした(図1)。
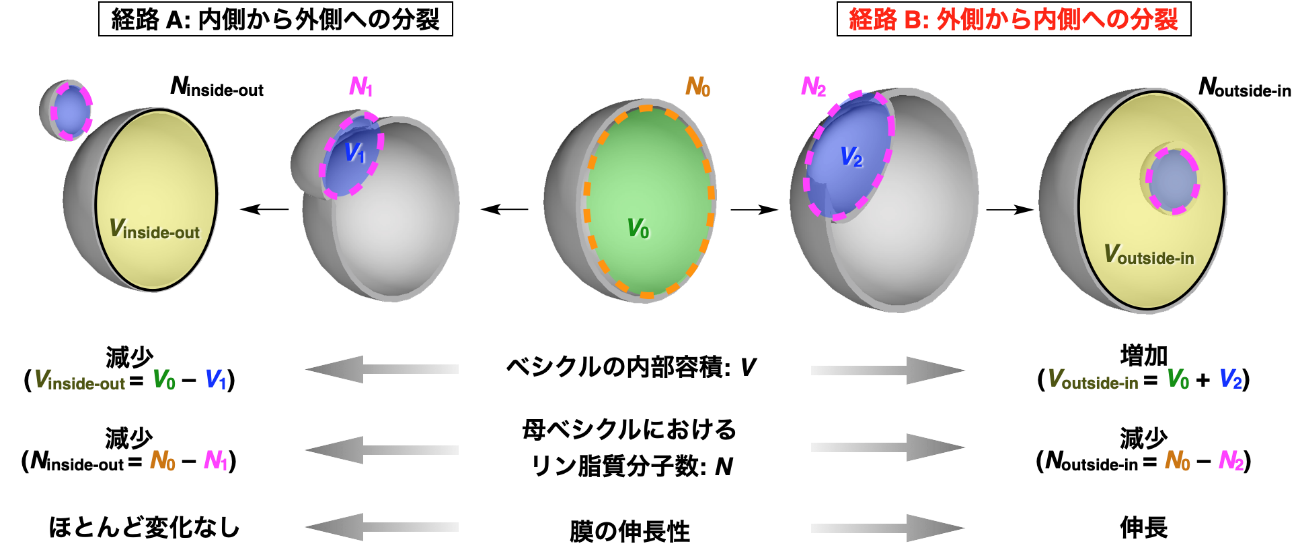
<研究の内容>
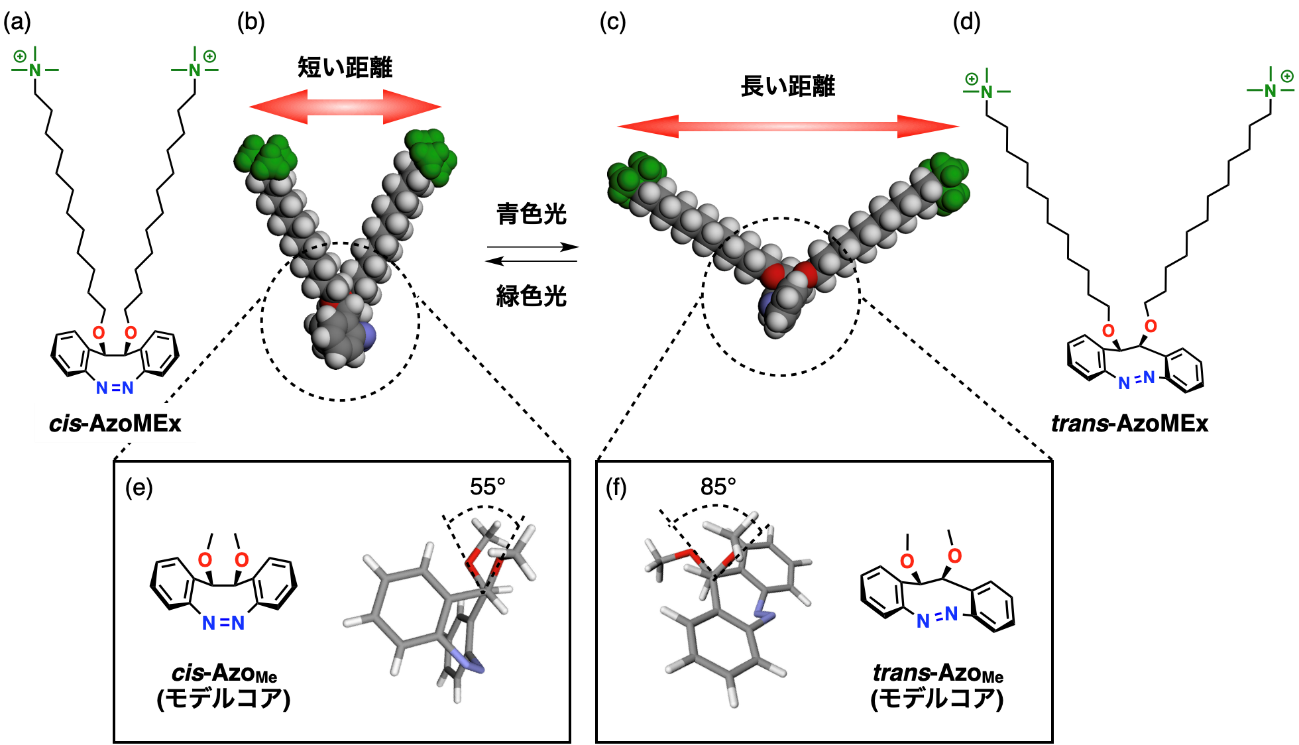
リポソームの内側への分裂を誘導するため、本研究グループは膜の伸長を可能にする光応答性分子機械AzoMExを設計しました(図2)。AzoMExはジアゾシン(架橋型アゾベンゼン)コアにアルキル鎖を介して親水性のトリメチルアンモニウム基が担持されています(図2a,d)。青色光照射により、ジアゾシンコア部がcis体からtrans体へと可逆的に異性化し、それに伴いコア部に結合したアルキル鎖のねじれ角が55°から85°へと変化します(図2e,f)。その結果、末端部のトリメチルアンモニウム基間の距離が大きくなるため、リン脂質膜にAzoMExを組み込み、青色光を照射しcis-AzoMExからtrans-AzoMEへ構造変化させることで、膜を伸長することが可能になります。
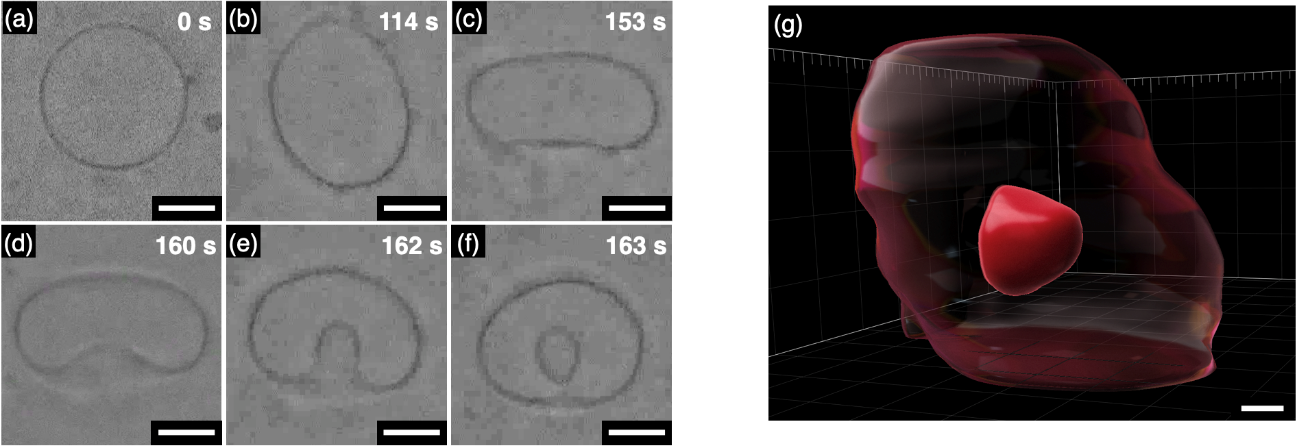
実際に、AzoMExをリン脂質であるDOPCからなる巨大単層ベシクルに10 mol%組み込み(GUVDOPC/AzoMEx)、青色光を照射したところ、リン脂質膜の伸長と共に内側への膜陥入、エンドサイトーシス様の小胞分裂が観察されました(図3)。興味深いことに、本手法では、従来のベシクル分裂において起こる内側から外側への分裂はほとんど観察されず、外側から内側への分裂が優先的に引き起こされることが明らかとなりました。
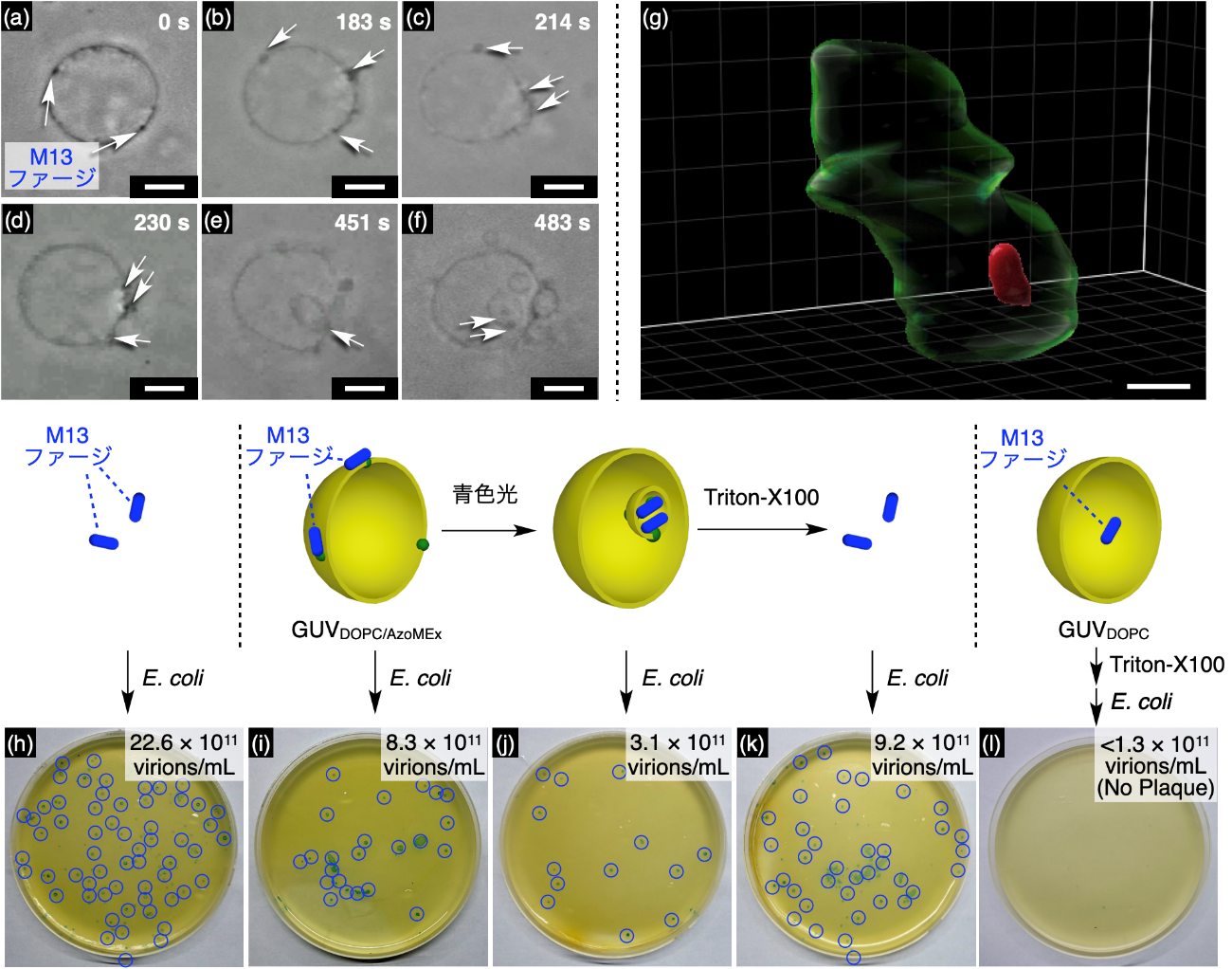
さらに興味深いことに、GUVDOPC/AzoMExの分散液にM13バクテリオファージウイルス(M13ファージ)を混合し、光を照射すると、AzoMExと結合したM13ファージが、分裂と共にリポソーム内部へと取り込まれることが明らかになりました(図4a-g)。また、リポソーム内に封入されたM13ファージは外部環境から保護され、感染対象である大腸菌E. coliを作用させた場合、感染量が大きく減少することがわかりました(図4j)。M13ファージが封入されたリポソームを分解させた後、E. coliを作用させた場合には感染力が復活したため、M13ファージが活性を保持したままリポソーム内に封入されていることが分かります(図4k)。さらに、これまで生体高分子をリポソーム内へ封入する方法として汎用的に利用されている静置水和法と比較すると、本研究のエンドサイトーシス様の分裂は、10倍以上高い効率でM13ファージを封入可能であることが明らかになりました(図4l)。
<今後の展開>
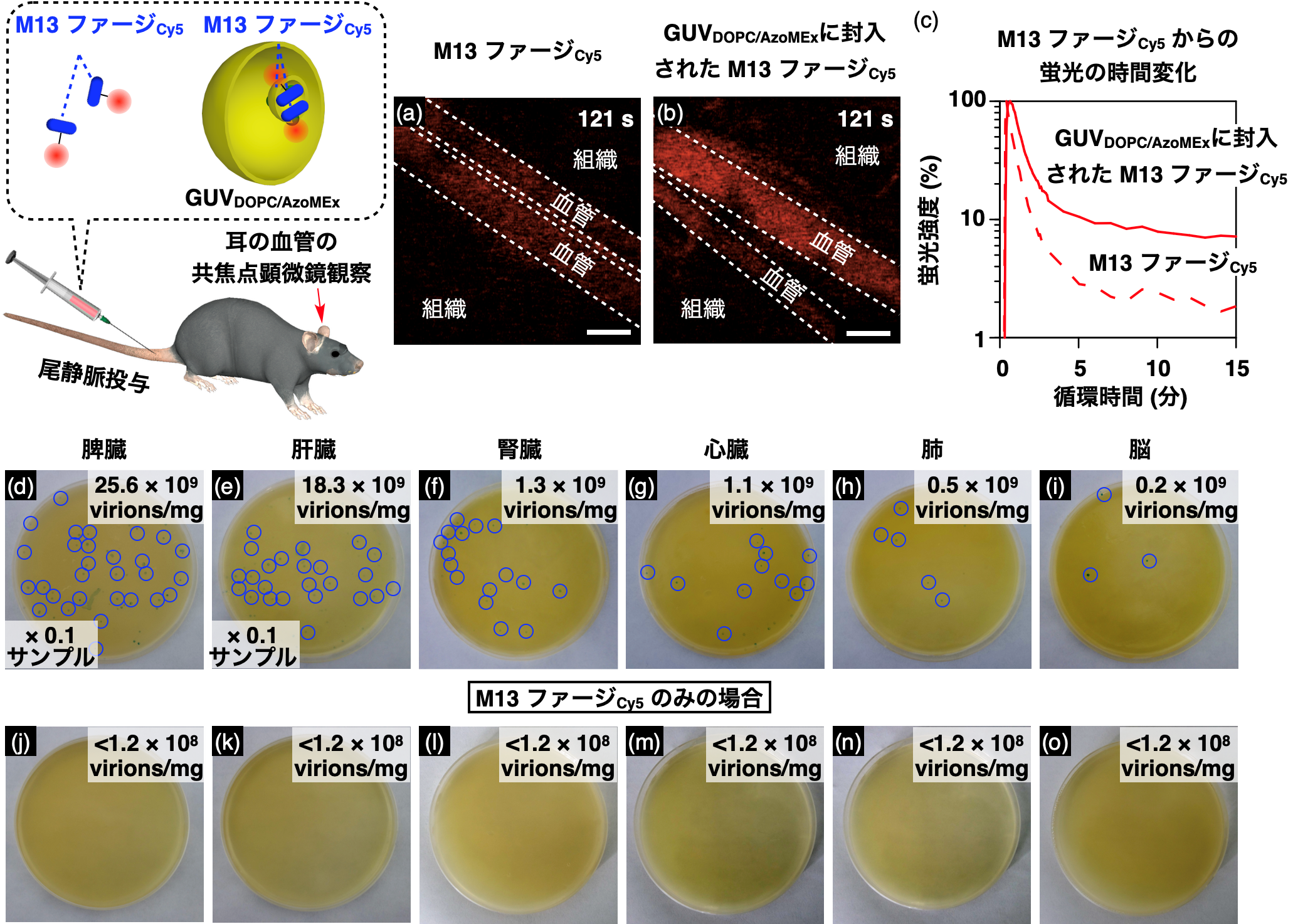
本研究グループが実現した、エンドサイトーシス様の分裂によってリポソーム内封入したM13ファージをマウス血中に投与したところ、血中内での安定性が向上し(図5a-c)、感染能が保持された状態で複数組織へと送達可能であることが明らかになっています(図5d-i)。このように生体高分子を効率的に封入?送達することが可能なキャリア材料の設計は、今なお困難であり、今後この膜変形リポソームは様々な生体高分子を生体内送達するためのキャリア材料へと応用されることが期待されます。
4. 発表雑誌
本研究成果は 2023年2月28日に、米国科学誌「Journal of the American Chemical Society」のオンライン版(オープンアクセス)て?公開されました。
論文タイトル: Endocytosis-like Vesicle Fission Mediated by a Membrane-Expanding Molecular Machine Enables Virus Encapsulation for in vivo Delivery
著者: Noriyuki Uchida*, Yunosuke Ryu, Yuichiro Takagi, Ken Yoshizawa, Kotono Suzuki, Yasutaka Anraku, Itsuki Ajioka, Naofumi Shimokawa, Masahiro Takagi, Norihisa Hoshino, Tomoyuki Akutagawa, Teruhiko Matsubara, Toshinori Sato, Yuji Higuchi, Hiroaki Ito, Masamune Morita, Takahiro Muraoka*
*責任著者
URL:https://pubs.acs.org/doi/10.1021/jacs.2c12348
注1) エンドサイトーシス
細胞膜が細胞内部へと陥入し、分裂する現象。外部から生体高分子を取り込む際に機能する。
注2) リポソーム
ナノ~マイクロメートルサイズの脂質二分子膜小胞。細胞膜モデルや薬物伝達システムの輸送体として利用されている。
注3) 分子機械
刺激に応答した分子の構造変化を利用し、高度な機械的機能をナノメートルスケールで実現する有機分子。
注4) M13ファージ
大腸菌E. coliに感染するマイクロメートルサイズの棒状ウイルス。遺伝子的にM13ファージに導入されたβガラクトシダーゼが感染したE. coli内で発現し、プレート内の色素分子と反応することで青点が生じる。
5. 問い合わせ先
<研究に関すること>
申博_申博信用网-官网 大学院工学研究院 応用化学専攻
特任助教 内田紀之(うちだのりゆき)
〒184-8588 東京都小金井市中町2-24-16
Tel: 042-388-7052 Fax: 042-388-7052
E-mail: n-uchida(ここに@を入れてください)go.tuat.ac.jp.
申博_申博信用网-官网 大学院工学研究院 応用化学専攻
教授 村岡貴博(むらおかたかひろ)
〒184-8588 東京都小金井市中町2-24-16
Tel: 042-388-7052 Fax: 042-388-7052
E-mail: muraoka(ここに@を入れてください)go.tuat.ac.jp.
関連リンク(別ウィンドウで開きます)
?申博_申博信用网-官网 村岡貴博教授 研究者プロフィール
?申博_申博信用网-官网 村岡貴博教授、内田紀之特任助教 研究室WEBサイト
?村岡貴博教授、内田紀之特任助教が所属する 申博_申博信用网-官网工学部応用化学科
